(Weymouth, Massachusetts, 23 de octubre de 1875 - Berkeley, 23 de marzo de 1946) físicoquímico estadounidense, famoso por su trabajo llamado "Estructura de Lewis" o "diagramas de punto".
En 1908 publicó el primero de varios artículos sobre la Teoría de la relatividad, en el cual dedujo la relación masa-energía por un camino distinto que Einstein.
En 1916 formuló la idea que un enlace covalente consiste en un par de electrones compartidos y creó el término molécula impar cuando un electrón no es compartido. Sus ideas fueron desarrolladas por Irving Langmuir y sirvieron de inspiración para los estudios de Linus Pauling.
Además, en ese año enunció la importante Regla del octeto.
En 1919, estudiando las propiedades magnéticas de soluciones de oxígeno en nitrógeno líquido, encontró que se había formado una molécula de O4. Esta fue la primera evidencia del oxígeno tetraatómico.
En 1923, formuló la teoría del par electrónico para las reacciones ácido - base.
Por el trabajo de J. Willard Gibbs era conocido que las reacciones químicas tienden a un equilibrio determinado por la energía libre de las sustancias intervinientes. Lewis dedicó 25 años a determinar la energía libre de varias sustancias y en 1923 él y Merle Nerdal publicaron los resultados del estudio y formalizaron la química termodinámica.
 Stanislao Cannizzaro:
Stanislao Cannizzaro: (Palermo, 13 de julio de 1826 – Roma, 10 de mayo de 1910) fue un químico y gobernador italiano que resolvió las confusiones surgidas acerca de las masas moleculares y atómicas.
Fue un hombre orgulloso que gozaba con las polémicas, lo que le llevó al principio de su vida al agitado mundo de la política. En 1848 agitó a Europa una serie de revoluciones, una de las cuales afectó al reino de Nápoles, del cual entonces formaba parte Sicilia.
Durante la revolución siciliana de independencia de 1848, Cannizzaro fue uno de los revolucionarios sirviendo como oficial de artillería, Messinay diputado por Francavilla en el parlamento siciliano. Después de la caída de Messina en septiembre de 1848 se instaló en Taormina. Tras la derrota de los insurrectos tuvo que huir, escapando a Marsella en mayo de 1849.
Mientras esperaba a que fuese segura su vuelta a la patria trabajó en Francia, donde después de visitar varias ciudades francesas llegó a París en el mes de octubre. Allí entró en el laboratorio de Michel-Eugene Chevreul, y junto con F. S. Cloz (1817-1883) hizo su primera contribución a la investigación química en 1851, cuando prepararon cianamida por la acción del amoníaco sobre el cloruro de cianogeno en una solución etérea.
Por su contribución en el congreso de Karlsruhe, de importancia fundamental para la teoría atómica en química, le concedieron la Medalla Copley de la Royal Society en 1891.
Amedeo Avogadro:
(Lorenzo Romano Amedeo Carlo Avogadro), Conde de Quaregna y Cerreto, (Turín, 9 de agosto de 1776 - † Turín, 9 de julio de 1856) fue un físico y químico italiano, profesor de Física en la universidad de Turín en 1834. Formuló la llamada Ley de Avogadro, que dice que volúmenes iguales de gases distintos bajo las mismas condiciones de presión y temperatura, contienen el mismo número de partículas. Avanzó en el estudio y desarrollo de la teoría atómica, y en su honor se le dio el nombre al Número de Avogadro.
En 1811,enunció la hipótesis que se ha hecho célebre, bajo el nombre de ley de Avogadro (por estar completamente comprobada). Avogadro se apoyó en la teoría atómica de John Dalton y la ley de Gay-Lussac sobre los vectores de movimiento en la molécula, y descubrió que dos volúmenes iguales de gases diferentes, en las mismas condiciones de presión y temperatura, contienen el mismo número de moléculas. Envía la memoria en la que desarrolla esta teoría al Journal de Physique, de Chimie et d'Histoire naturelle que lo publica el 14 de julio de 1811 bajo el título Ensayo de una forma de determinar las masas relativas de las moléculas elementales de los cuerpos, y las proporciones según las cuales entran en estas combinaciones. La dificultad más importante que tuvo que superar concernía a la confusión existente en aquella época entre átomos y moléculas. Una de sus contribuciones más importantes es clarificar la distinción entre ambos conceptos, admitiendo que las moléculas pueden estar constituidas por átomos (distinción que no hacía Dalton, por ejemplo). En realidad, no utilizó la palabra átomo en sus trabajos (en aquella época los términos átomo y molécula se utilizaban de manera indistinta), pero él considera que existen tres tipos de moléculas, de las cuales una es una molécula elemental (átomo). También efectúa la distinción entre los términos masa y peso.
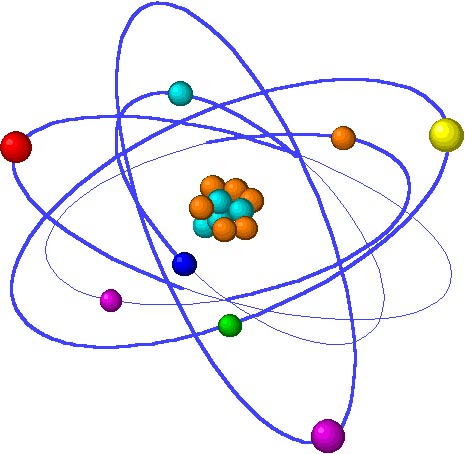
Niels Henrik David Böh:
(Copenhague, Dinamarca; 7 de octubre de 1885 – ibídem; 18 de noviembre de 1962) fue un físico danés que realizó fundamentales contribuciones para la comprensión de la estructura del átomo y la mecánica cuántica.
Nació en Copenhague, hijo de Christian Bohr, un devoto luterano catedrático de fisiología en la Universidad de la ciudad, y Ellen Adler, proveniente de una adinerada familia judía de gran importancia en la banca danesa, y en los «círculos del Parlamento». Tras doctorarse en la Universidad de Copenhague en 1911, completó sus estudios en Mánchester teniendo como maestro a Ernest Rutherford.
En 1916, Bohr comenzó a ejercer de profesor en la Universidad de Copenhague, accediendo en 1920 a la dirección del recientemente creado Instituto de Física Teórica.
En 1943, con la 2ª Guerra Mundial plenamente iniciada, Bohr escapó a Suecia para evitar su arresto por parte de la policía alemana, viajando posteriormente a Londres. Una vez a salvo, apoyó los intentos anglo-americanos para desarrollar armas atómicas, en la creencia errónea de que la bomba alemana era inminente, y trabajó en Los Álamos, Nuevo México (EE. UU.) en el Proyecto Manhattan.
Después de la guerra, abogando por los usos pacíficos de la energía nuclear, retornó a Copenhague, ciudad en la que residió hasta su fallecimiento en 1962.